药物毒副作用 (adverse drug reactions, ADRs)是长期困扰医药学界的一个难题。迄今为止, 大约有 4% 的新药由于毒副作用而被迫撤市。药物毒副作用可分为 Type A 和 Type B 两种类型, 其中 Type B 为 遗传异质性药物毒副作用, 与人类基因的单核苷酸多态性 (single nucleotide polymorphism, SNP) 以及基因拷贝数变异有关, 约占全部药物毒副作用的15% 左右。
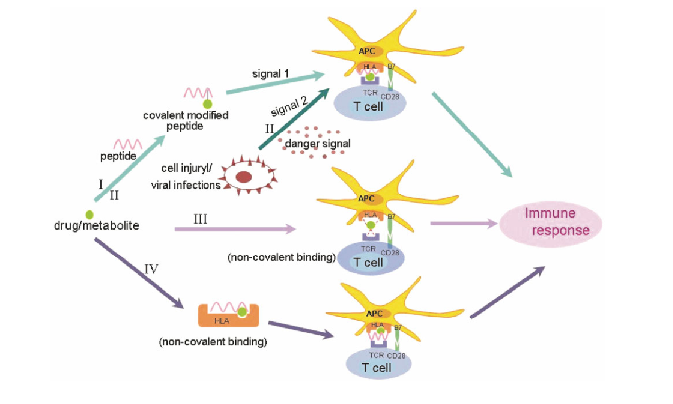
近年来, 全基因组关联分析 (genome-wide association study, GWAS) 被越来越多地应用于遗传异质性 ADRs 的研究中, 越来越多的研究发现: 遗传异质性 ADRs 与人类白细胞抗原 (human leukocytes antigen, HLA) 基因密切相关。
最早引起广泛关注的是抗艾滋病药物阿巴卡韦 (abacavir) 引发的 ADRs。2002 年, Mallal 等[8]首次发现: 约 94.4% 的 Abacavir-ADRs 患者携带有 HLAB*5701 等位基因, 而对照组中仅为 1.7%, 即 Abacavir-ADRs 与 B*5701 基 因 显 著 关 联 。 随 后 , 别 嘌 醇 (allopurinol) 、 卡马 西平 (carbamazepine) 、 希 美 加 群 (ximelagatran)、氯氮平 (clozapine)、噻氯匹定 (ticlopidine)、氟氯西林 (flucloxacillin) 等引发的 ADRs 也相继被发现与特定 HLA 基因显著相关 (表 1)。 此后, 相关机制研究也纷纷展开, 并在 2012 年取得了突破性进展。
阿巴卡韦与 HLA-B*5701
阿巴卡韦是临床上 常用的抗艾滋病药物, 属于核苷类逆转录酶抑制剂。约 4%~8% 的患者使用阿巴卡韦后出现超敏反 应 (hypersensitivity syndrome, HSS) 症状。停药后,HSS 症状消失, 若再次服用则病症加重, 甚至导致死亡。
2002 年, Mallal 等[8]随机选取澳大利亚 200 例艾滋病患者进行 GWAS 研究, 其中有 18 例 (9.0%) 患者服用阿巴卡韦后出现明显毒副作用, 167 例患者耐受。研究显示: 18 例超敏反应患者中有 14 例 (78%) 携带 HLA-B*5701; 而 167 例耐受患者中只有 4 例 (2%) 携带该基因, 关联极显著 (odds ratio=117; Pc<0.0001)。
2004 年, Martin 等[9]对澳大利亚 248 例艾滋病患者进行了 GWAS 研究。服用阿巴卡韦后, 18 例患者 (7.3%) 出现明显超敏反应, 230 例患者耐受。18 例患 者中有 17 例 (94.4%) 携带 B*5701 基因, 而耐受组 中仅有 4 例 (1.7%), 相关性也极为显著 (odds ratio =
960; P < 0.000001)。随后的一系列研究结果均显示阿 巴卡韦的超敏反应与 B*5701 密切相关[8-12]。鉴于这一重要发现: 澳大利亚、英国、美国等纷纷采取措施, 要求在出具阿巴卡韦处方之前, 必须进行 HLA 基因型鉴定。
为评估 B*5701 基因型鉴定举措的有效性, Mallal 等[55]采用双盲法随机选择了来自 19 个国家且从未服 用过阿巴卡韦的 1 650 名艾滋病患者进行研究。Mallal 等首先将患者按 1∶1 比例随机分为 2 组, 其中预筛选组的 803 例患者在阿巴卡韦治疗前进行 B*5701 基因型鉴定, 避免 B*5701 携带者接受阿巴卡韦治疗;对照组的 847 例患者不进行 B*5701 基因型筛查, 其他处理均与预筛选组一致。结果显示: 当采用临床ADRs 判断标准时, 预筛选组超敏反应发病率为 3.4%(27/803), 明显低于对照组 7.8% (66/847) 的发病率(odds ratio = 0.40; P < 0.001)。研究表明: B*5701 基因型鉴定可大幅减低阿巴卡韦超敏反应的发生率。
此外, 研究显示: 在黑种人和西班牙人群中, 阿巴卡韦引发超敏反应的发生率相对较低, 推测是由于 B*5701 基因出现频率较低造成的。
卡马西平与 HLA-B*1502 和 A*3101
卡马西平 (CBZ) 系广谱抗癫痫药, 同时对癫痫并发的精神症状亦有疗效。在 CBZ 治疗过程中, 患者常会出现 StevensJohnson 综合征 (Stevens-Johnson syndrome, SJS)、中毒 性表皮坏死松解症 (toxic epidermal necrolysis, TEN)、斑 丘 疹 (maculopapular eruption, MPE) 等 毒 副 作
用[57, 58], 其中以 SJS 和 TEN 最为常见。
2004 年, Chung 等[20]对台湾汉族人群中 44 例 CBZ 引发的 SJS 患者进行了基因关联分析, 其中 5 例 同时伴有 TEN。对照组为 101 例 CBZ 耐受患者和 93例健康受试者。结果显示: 100% (44/44) 的 CBZ-SJS 患 者携带 B*1502, 仅有 3% (3/101) 的耐受患者 (odds ratio=2504; Pc=3.13×10-27) 以及 8.6% (8/93) 的健康 受试者携带有 B*1502 (odds ratio = 895; Pc = 1.38×10-21) 。 研 究 同 时 发 现 : B*1502-Cw*0801-A*1101-DRB1*1202 单倍型与 CBZ-SJS 关联性亦十分显著, 约 66% 的 CBZ-SJS 患者携带该单倍型, 而在耐受组中为零, 健康受试组为 3%。
Locharernkul 等[23]对 1994~2007 年间 31 例由 抗癫痫药物引发 SJS 和 (或) MPE 的泰国患者进行了基因关联研究。31 例患者包括 6 例 CBZ-SJS、4 例Phenytoin-SJS、9 例 CBZ-MPE 和 12 例 Phenytoin-MPE; 对照组为 50 例耐受患者。结果显示: 6 例 (100%) CBZ-SJS 患者均为 B*1502 阳性, 8 例 (16%) 耐受患者为 B*1502 阳性, 关联极显著 (odds ratio = 25.5;P = 0.0005); 4 例 (100%) Phenytoin-SJS 患者也均为B*1502 阳性。而对于 MPE 患者, 则未发现存在显著的关联基因。
目前, 仅在台湾和泰国等地发现 CBZ-SJS/TEN 与 B*1502 的显著关联, 而在欧洲和日本却发现 CBZ 引发的严重皮肤反应 (severe cutaneous adverse reactions,SCAR) 与 HLA-A*3101 存在显著性关联。
Ozeki 等[24]对日本 53 例 CBZ-SCAR 患者和 882名健康受试者进行了基因关联研究。结果显示, CBZSCAR 与 HLA-A 基因座的 rs1633021 具有显著关联 性 (P=1.18×10-13)。随后对 61 例 CBZ-SCAR 患者和 376 例 CBZ 耐受患者的进一步研究显示: 60.7% (37/61)的 CBZ-SCAR 患者携带 A*3101 基因, 只有 12.5%(47/376) 的耐受患者携带 A*3101 (odds ratio = 10.8,P = 3.64×10-15)。
在对欧洲癫痫患者的研究中[61], 同样发现 CBZSCAR 与 A*3101 具有显著性关联。结果显示: 37.01% (10/27) 的 CBZ-HSS 患者携带 A*3101 (odds ratio =12.41, P = 0.03); 21.7% (23/106) 的 CBZ-MPE 患者携带 A*3101 (odds ratio = 8.33, P = 8.0×10-7); 42%的(5/12) 的 CBZ-SJS/TEN 患者携带 A*3101 (odds ratio=25.93, P = 8.0×10-5) , 而仅有 3.89% (10/257) 的耐受患者携带有 A*3101。
鉴于亚洲地区 CBZ-SJS 与 B*1502 的显著关联性, 美国食品药品监督管理局 (FDA) 等机构建议对亚洲人出具 CBZ 处方前进行 B*1502 基因型鉴定。
别嘌醇与 HLA-B*5801
别嘌醇是一类酶抑制剂,可阻碍尿酸的生物合成, 主要用于痛风的治疗。别嘌醇常会引发 SJS 和 TEN 等不良反应, 约占全部药物引发 SCAR 的 5%[63], 死亡率也高达 26%~30%。
2005 年, Hung 等[15]研究发现别嘌醇引发的 SCAR 与 B*5801 呈显著性关联。51 例患者服用别嘌醇后出现 SCAR, 包括 SJS (13 例)、SJS&TEN (5 例)、TEN(3 例) 和 HSS (30 例)。对照组采用 135 例别嘌醇耐受患者和 93 例健康受试者, 所有受试者均来自台湾。研究发现: 51 例 Allopurinol-SCAR 患者均为 B*5801 阳性 (100%), 而耐受组中只有 20 例 (15%) 患者为B*5801 阳性 (odds ratio = 580.3; Pc = 4.7×10-24); 健康对照组中只有 19 例 (20%) (odds ratio = 393.5; Pc =8.1×10-18)。
2009 年, Tassaneeyakul 等 [17]对泰国的 27 例 Allopurinol-SJS/TEN 患者和 54 例别嘌醇耐受患者进 行了研究。结果显示: 27 例 (100%) Allopurinol-SJS/ TEN 患者均携带 B*5801, 而对照组只有 7 例 (12.96%) 患者携带 B*5801 (odds ratio = 348.3; P = 1.6×10-13)。
此外, 在日本[16]和韩国[19, 64]等地也得到了类似的研究结果。
相对于亚洲, 欧洲人群中 B*5801 出现频率相对 较低, 但也发现了类似的关联性[28]。尽管美国 FDA等机构还没作出相关建议, 但就目前情况看, 进行B*5801 基因型鉴定不失为预防别嘌醇超敏反应的一种有效方法。
非普拉宗 (feprazone) 与 HLA-B*22
固定性药疹 (fixed-drug eruption, FDE) 是服用同种药物后常在同一部位发生的皮肤和 (或) 黏膜损伤的不良反应, 多表现为重症红斑型、大疱性表皮坏死松懈型药疹等[65], 具有病情急重、病程长和死亡率高等特点。
针对吡唑酮类非甾体抗炎药非普拉宗诱导的FDE 常具家族遗传性的特点, Pellicano 等[25]对来自斯堪的纳维亚 7 个家族的 20 例 FDE 患者和 40 例无血缘关系的 FDE 患者进行了基因关联研究, 对照组为215 名志愿受试者。基因关联研究结果显示: 来自 7 个家族的 18 例 Feprazone-FDE 患者均携带 HLA-B*22,26 例无血缘关系的 Feprazone-FDE 患者携带 B*22,而对照组仅有 8 例 (4%) 携带 B*22 基因 (odds ratio =48.0; P < 0.05)。
由于 Pellicano 的研究缺少非普拉宗耐受对照组,同时也缺乏相关研究的进一步支持, 因此 FeprazoneFDE 与 HLA-B*22 的基因关联性仍需进一步验证。
氟氯西林与 HLA-B*5701
药物导致的肝毒 (drug-induced liver injury, DILI) 一直是新药临床试 验终止和药物撤市的主要原因[66], 约有 75% 的 DILI 患者表现为急性肝功能衰竭, 严重的可导致死亡。氟氯西林属耐酶青霉素类, 主要用于治疗耐青霉素 G 的金葡菌感染。调查显示: 英国每 10 万个患者中约有 8.5 个患者在初次接受氟氯西林治疗 1~45天后出现 DILI 症状。Daly 等[26]对欧洲的 Flucloxacillin-DILI 患者进行了全基因组 SNP 研究。测试组选取 51 例 FlucloxacillinDILI 患者, 对照组为 64 例氟氯西林耐受者。结果显示: 测试组中有 43 例 (84%) 患者携带与 B*5701 基因完全连锁不平衡的 rs2395029, 而只有 4 例 (5%) 耐受者携带 rs2395029, 关联极显著 (odds ratio = 80.6;P = 8.97×10-19)。据估计, 只有 1/1000 至 1/500 的 B*5701 阳性个体服用氟氯西林后出现 DILI, 暗示 FlucloxacillinDILI 还可能涉及其他因素。
阿司匹林 (aspirin) 与 HLA-II 基因
阿司匹林为常见非甾体类抗炎药, 其作用机制是通过抑制体内环氧化酶活性而减少局部组织前列腺素 (PG) 的生物合成。在临床上, 服用阿司匹林的患者常出现荨麻疹 (aspirin-induced urticaria, AIU)、阿司匹林哮喘(aspirin-intolerant asthma, AIA)、结膜炎、过敏等不良
反应,Kim 等[33]对韩国 94 例 AIU 和 76 例 AIA 患者以及 185例健康受试者进行了基因关联研究。结果显示: AIU 与 DRB1*1302、DQB1*0609、DRB1*1302-DQB1*0609-DPB1*0201 单倍型具显著相关性。尤其是 DRB1*1302-DQB1*0609-DPB1*0201 单倍型, 其在 AIU 组的出现频率为 8.0%, 明显高于 AIA 组的0.7% (Pc = 0.001 4) 和健康组的 2.0% (Pc = 0.000 6)。Dekker 等[36]对波兰的 59 例 AIA 患者进行了基因关联研究, 对照组采用 48 例健康受试者和 57 例普通哮喘患者。结果显示: 约 19.5%的 AIA 患者携带有DPB1*0301, 显著高于健康组的 5.2% (odds ratio =4.4, Pc = 0.02) 和普通哮喘组的 4.4% (odds ratio = 5.3;Pc = 0.004)。此外, Choi 等[37]对韩国 76 例 AIA 患者的基因关联研究也取得了相同的结论。AIA 和 AIU 与上述基因型的关联性相对较弱,可能涉及 TNFα、TGFβ1 和 IL-1 等其他因素。
肼苯哒嗪 (hydralazine) 与 HLA-DRw4
自肼苯哒嗪首次作为抗高血压药应用于临床以来, 越来 越多的数据显示: 肼苯哒嗪可导致部分患者出现系
统性红斑狼疮 (hydralazine-induced systemic lupus erythematosus, SLE) 症状。SLE 是多系统自身免疫 疾病, 主要症状为发热、贫血、白细胞和血小板减少、瘀斑、皮疹等。Cameron 等[73]研究发现, 女性的SLE 发病率 (6.7%) 显著高于男性 (2.8%)。Batchelor 等对 26 例 Hydralazine-SLE 患者进行了研究, 其中 25 例为慢乙酰化表型。研究共采用了 3 组对照: 对照组 (1) 为 113 例健康受试者, 无慢乙酰化表型; 对照组 (2) 为 16 例肼苯哒嗪耐受患者,且为慢乙酰化表型; 对照组 (3) 为 20 例原发性 SLE患者。结果表明: DRw4 在 26 例 Hydralazine-SLE 患者中的出现频率(73%) 远高于 3 个对照组的 33%、25% 和 25%。此外, 研究显示: Hydralazine-SLE 与慢乙酰化表型也密切相关, 因而建议 DRw4 基因型和慢乙酰化表型的患者, 尤其是女性患者应避免服用肼苯哒嗪。由于该研究的样本容量相对较小, 同时缺乏其他研究结果的支持[74], 因此上述关联还需进一步验
证。
奈韦拉平 (nevirapine) 与 HLA-I 和 HLA-II 基因
奈韦拉平是一类治疗 HIV-1 感染的非核苷逆转录酶抑制剂。临床研究表明: 服用奈韦拉平后, 约48% 的患者会出现全身反应或皮肤反应, 4.9% 的患
者会引发肝毒[75, 76], 0.3% 的患者则会出现 SJS/TEN等严重皮肤反应。
肼苯哒嗪可导致部分患者出现系统性红斑狼疮 (hydralazine-induced systemic lupuserythematosus, SLE) 症状。SLE 是多系统自身免疫
疾病, 主要症状为发热、贫血、白细胞和血小板减少、瘀斑、皮疹等[72]。Cameron 等[73]研究发现, 女性的SLE 发病率 (6.7%) 显著高于男性 (2.8%)。Batchelor 等[39]对 26 例 Hydralazine-SLE 患者进行了研究, 其中 25 例为慢乙酰化表型。研究共采用了 3 组对照: 对照组 (1) 为 113 例健康受试者, 无慢乙酰化表型; 对照组 (2) 为 16 例肼苯哒嗪耐受患者,且为慢乙酰化表型; 对照组 (3) 为 20 例原发性 SLE患者。结果表明: DRw4 在 26 例 Hydralazine-SLE 患者中的出现频率 (73%) 远高于 3 个对照组的 33%、25% 和 25%。此外, 研究显示: Hydralazine-SLE 与慢
乙酰化表型也密切相关, 因而建议 DRw4 基因型和慢乙酰化表型的患者, 尤其是女性患者应避免服用肼苯哒嗪。
奈韦拉平 (nevirapine) 与 HLA-I 和 HLA-II 基因
奈韦拉平是一类治疗 HIV-1 感染的非核苷逆转录酶抑制剂。临床研究表明: 服用奈韦拉平后, 约48% 的患者会出现全身反应或皮肤反应, 4.9% 的患
者会引发肝毒[75, 76], 0.3% 的患者则会出现 SJS/TEN等严重皮肤反应[77]。
Littera 等[78]曾对撒丁岛 49 例服用奈韦拉平的患者进行了基因关联研究, 其中 13 例 (26%) 患者出现超敏反应症状, 36 例患者耐受。研究显示: 46% (6/13)的超敏反应患者携带 Cw*0802-B*1402 单倍型基因,而对照组中只有 5% (2/36) 携带此单倍型 (P = 0.004;Pc = 0.05)。Gatanaga 等[79]在日本人群中也做了类似的基因关联分析, 研究显示: 奈韦拉平超敏反应组中有 42% 的患者为 HLA-Cw 阳性, 显著高于耐受组的10% (P = 0.03) 和普通日本人群的 9%~14%。
然而, 也有研究显示奈韦拉平引发的肝毒和超敏 反应与 DRB1*0101 存在相关性[80]。2008 年, Vitezica 等[81]对法国高加索地区的 21 例 HIV 患者进行了基因 关联研究, 其中 6 例表现为奈韦拉平超敏症状, 15 例为奈韦拉平或依法韦仑 (efavirenz) 耐受。结果显示:83% (5/6) 的超敏患者携带 DRB1*01, 而只有 7%(1/15) 的耐受患者携带该基因 (Pc = 0.04)。
Chantarangsu 等[50]对泰国人群中奈韦拉平导致的皮疹进行了基因关联研究。研究显示: 测试组中B*3505 基因型的分布频率为 17.5%, 耐受组为 1.1% (odds ratio = 18.95; Pc = 4.6×10-6), 而健康受试组中 仅为 0.7% (odds ratio = 29.87; Pc = 2.6×10-5), 关联性极显著。
随着基因测序技术的快速发展以及测序成本的急剧降低, 给遗传异质性 ADRs 及其他疾病的生物标记分子以及机制研究提供了广阔的发展空间和机遇。以阿巴卡韦为例, 从临床结果到基因关联研究和标记分子确定, 最后到临床 B*5701 基因筛查举措和分子机制研究, 可以说是个性化医疗事业的一个成功案例和里程碑事件。但与此同时, 基因关联研究也面临一系列困难和问题, 如 ADRs 临床诊断标准的规范、单体型分析技术的完善、多基因共同引发 ADRs 情况下标记分子的确定等。
尽管 HLA 介导的遗传异质性药物 ADRs 机制的 研究已取得巨大突破, 但一些问题也还远远没有得 到解答, 如为何只有部分 B*5701 携带者服用阿巴卡韦时发生 ADRs?还有哪些遗传因子或环境因子影 响 ADRs 的发生?同时, 已有研究结果似乎也暗示: 遗传异质性 ADRs 可能遵循多种不同的分子作用机 制, 如磺胺甲噁唑引发的 ADRs 可能与阿巴卡韦具有不同的作用机制。
此外, 遗传异质性药物 ADRs 研究的不断深入也为相关药物研发及安全评价提出了新的研究课题, 即如何在药物研发阶段降低临床 ADRs 的发生率, 如何发展有效的用于 ADRs 预测的动物模型等。