 联系我们
联系我们
 010-67709643
010-67709643
The NEW ENGLAND JOURNAL of MEDICINE
Yizhou Zou, M.D., Peter Stastny, M.D., Caner Susal, M.D., Bernd Dohler, Ph.D., and Gerhard Opelz, M.D.
摘要
背景:肾移植患者即便HLA配型结果很理想,如HLA-A、HLA-B和HLA-DR三个位点相配的很好,也不能保证移植术后不会发生排斥反应。提示除了HLA抗原外,还可能存在与排斥有关的其它抗原。业已证实,MICA抗原具有很强的多态性,并能诱发产生相应的抗MICA抗体 (MICA为MHC Class I related Chain A抗原的缩写)。本研究旨在确定针对MICA抗原的免疫反应是否可以造成肾移植排斥。
方法:我们收集了1,910例肾脏来源为尸肾的肾移植患者术前的血清标本。通过Luminex细胞流式仪检测这些血清标本是否存在MICA抗体。其检测原理为:将每一种MICA抗原包被在相应的微磁珠上。如果血清中存在某种MICA抗体,相应的磁珠就会与血清中的抗体发生反应。Luminex流式细胞仪可以确定抗体的存在及强度。
结果:1,910例患者中,检测出MICA抗体的患者有217例,占总数的11.4%。 这些具有MICA抗体的患者,其第一年器官存活率为88.3%。而血清中没有MICA抗体
的其余患者的第一年存活率为93.0% (P=0.01)。提示肾移植排斥与MICA抗体有关。 如果只计算1,910例患者中的首次移植患者, MICA抗体阳性者的第一年存活率为87.8%。而MICA抗体阴性者的第一年存活率为93.5%(P=0.005) 差别更为明显。此外,在326例HLA配型较理想的患者中(既HLA零错配或其中一个位点的一个抗原错配),具有MICA抗体的患者,其第一年存活率为83.2%,而没有MICA抗体的患者,其第一年存活率为95.1%(P=0.002)。
结论:MICA抗体的存在与移植物丢失有关,并可导致HLA配型结果理想的患者其移植物的丢失。MICA抗原的表面糖蛋白具有很强的免疫功能,MICA抗原在内皮细胞、神经末梢细胞、纤维原细胞、上皮细胞以及许多肿瘤细胞上表达,但不在外周血中的淋巴细胞上表达。与HLA抗原相同,在器官移植中MICA抗原也可诱发MICA抗原的形成。众所周知,HLA抗体,特别是那些针对供体HLA抗原的抗体,可以严重损伤移植物。供体与患者的交叉配型阳性时,可导致超急性排斥,HLA抗体与急性排斥和慢性排斥都有很大的关系。因为MICA抗原不在淋巴细胞上表达,所以通过交叉配型试验无法检测出抗MICA抗体。然而,具有多态性的MICA抗原在内皮细胞上表达,并在血清中补体的作用下也表现出细胞毒的反应,因此,MICA抗体的存在也会对移植物有损害。
以往的一些研究表明,MICA抗体可影响肾移植存活率。此外,通过对排斥过程中肾脏洗脱液的研究也提示MICA抗体参与了排斥过程中的病理变化。遗憾的是,这些研究均来自比较小的样本量。本研究通过大的标本量,即收集了1,910例肾移植患者术前的血清,检测MICA抗体, 并与临床相应的指标汇总研究。
方法
样本收集:在1990年至2004年期间,共有来自13个国家20个中心收集的1,910例肾移植患者术前的血清。这些中心的分析工作依照地方伦理以及患者的知情权的要求,将样本数据准确地记录下来,并向患者保证其数据只用作科学研究。这项研究通过了荷兰海德堡大学伦理委员会的认可。
实验室检测:对这些血清样本进行的HLA一类和二类抗体的检测,其方法为ELISA方法(酶联免疫法)。检测MICA抗体的方法为Luminex流式细胞微磁珠方法。
统计学分析:对移植后的移植物功能的分析数据分别取自术后3个月、6个月和12个月的患者,无一例外。其中23个患者(占1.2%)在移植术后的3至6个月内移植物失功,34个患者(占1.8%)在移植术后的6至12个月之间移植物失功。统计方法采用的是: Kaplan-Meier方法和多变量COX回归分析法。移植年代、移植次数、供者的年龄和受者的年龄;患者性别和民族、原发疾病、所在地区;HLA-A、HLA-B和HLA-DR分型的错配情况;PRA抗体的百分比;HLA一类/二类抗体;冷缺血时间;免疫抑制剂的使用类别;术前血浆置换的次数等均作为重要变量给以统计。使用的统计学软件:SPSS(14.0版)和SAS(8.2版)。
结果
表1为MICA抗体阳性与阴性时患者的基本特征。其中三项具有统计学上的差异 (P<0.05),如移植年代、冷缺血时间和药物应用。2000年至2004年间的患者血清MICA抗体阳性的比例较高,这可能与早期样本收集的质量有关。一些1995年前收集的血清标本,因量不足而无法进行MICA抗体的检测。此外, MICA抗体阴性患者的冷缺血时间长于MICA抗体阳性患者(平均19.7小时比18.1小时,P=0.007)。MICA抗体阳性患者应用Mycophenolic Acid的比例较高 (68%比61%,P=0.006)。

在这1,910例肾移植患者中,检测出MICA抗体的有217例,占11.4%。 MICA抗体的出现与移植后排斥相关(参见图1)。具有MICA抗体的患者,其第一年移植存活率为88.3±2.2%,而MICA抗体阴性的患者第一年存活率为93.0±0.6%(P=0.01)。在移植后被观察的五年中一直存在统计学上的显著差异,如果只统计首次移植的患者,MICA抗体阳性的患者有183人,其第一年存活率为87.8%。而MICA抗体阴性的1,473名患者的第一年存活率为93.5%(P=0.005)。此外,MICA抗体对肾移植存活率的影响对HLA配型较好的患者更为明显。例如:326例患者的HLA配型较为理想,既零错配或一位点中的一个抗原错配,其中MICA抗体阳性者第一年存活率为83.2%。而MICA抗体阴性者的第一年存活率为95.1% (P=0.002)。与之相反,MICA抗体对HLA配型不好的患者未见明显的影响。这可能与统计的标本量小有关,由此提示,当患者存在MICA抗体时,
其对肾移植存活率的影响与是否同时存在HLA抗体无关。在这1,910 例患者中, 同时具有MICA抗体和HLA一类抗原产生的HLA抗体者仅37人(1.9%)。同时具有MICA抗体和HLA二类抗原产生的HLA抗体者仅35人(1.8%)。
此外,MICA抗体与移植排斥的强关联并不受HLA抗体的影响 (参见图2)。
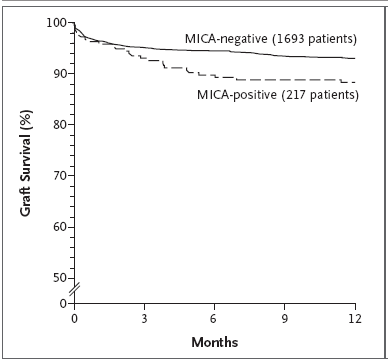
图1:该图是移植患者术前MICA抗体阳性对存活率的影响。 在1,910例患者中,具有MICA抗体的217例患者的移植存活率明显降低(P=0.01)。
例如:1,626例患者的 PRA抗体是0%,其中具有MICA抗体者177人。而这177名患者器官存活率明显低于无MICA抗体者(87.4% 比93.4%,P=0.004)
表2显示MICA对不同患者组的影响。通过多变量分析软件,证实 MICA抗体对首次移植 的存活率存在明显的影 响。器官排斥的风险比例平均为1.86 (95%可信区间1.17-2.97,P=0.009)。对于HLA配型较好的患者,MICA抗体导致的器官排斥风险比例平均为5.19(95%可信区间1.94-13.88,P=0.001)。对于没有HLA抗体的患者,MICA抗体造成的器官排斥风险比例平均为1.85(95%可信区间1.23-2.78,P=0.003)。表2中其它变量与MICA抗体未见统计学上的差异。
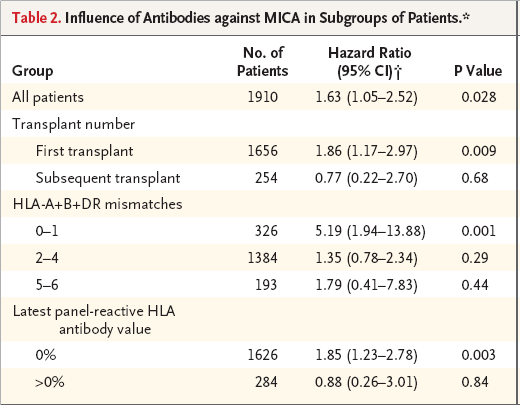

图2:该图是肾移植存活患者术前检测出MICA抗体并与PRA抗体有关。
在移植存活的1,626例患者中无MICA抗体的有1449例,其中MICA抗体阳性者117例, 移植存活率明显降低(P=0.004)。
我们试图从那些等待肾移植的患者中找到产生MICA抗体的免疫反应根源,为此,我们比较了
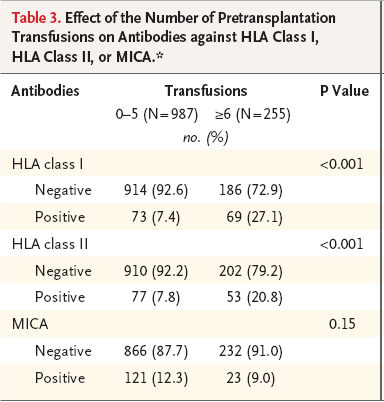
移植前输血及输血数目对产生MICA抗体和HLA抗体的影响。 表3显示,在142名具有一类HLA抗体的
患者中,48.6%接受了六次或六次以上的输血。而1,100 名没有一类HLA抗体的患者中只有16.9%的人接受六次或六次以上的输血 (P<0.001)。同样,具有二类HLA抗体的患者比没有相应抗体的患者接受更多的输血(P<0.001)。然而,输血频率与MICA抗体的产生无关 (P=0.15)。提示输血诱发的免疫反应不参与MICA抗体的产生。我们同时观察到,具有HLA抗体的患者较之没有HLA抗体的患者更容易同时存在MICA抗体。例如:220名具有一类HLA抗体的患者中,同时具有 MICA抗体者有37人(16.8%)。而在1,684名没有
一类HLA抗体的患者中,具有MICA抗体者有180人(10.7%)。两组相比,P=0.007。同样,在204例具有二类HLA抗体的患者中,同时具有MICA抗体者有35人(17.2)。而在1,692名没有二类HLA抗体的患者中,具有MICA抗体者有182人(10.8%)。两组相比,P=0.007。
讨论
我们的研究表明,肾移植前如果体内存在MICA抗体,可明显降低移植器官的存活率。而MICA抗体诱发的移植物丢失往往发生在移植后的早期。这是移植前抗体形成所介导的排斥反应的典型特征。我们以前曾报道过,一些等待肾移植的患者具有MICA抗体。而且,在移植排斥的患者中发现高频率的MICA抗体和MICB抗体(抗MIC-B位点等位基因抗体)。我们的研究结果提示,移植前MICA抗体的产生与输血无关。这与输血诱发HLA抗体的产生明显不同,我们推测,环境中某些物质的交叉反应可通过免疫系统产生MICA抗体。
我们也观察到,在HLA配型较好的患者中, MICA抗体与器官排斥的关系仍然很明显。移植前存在MICA抗体者,移植后三个月内移植物丢失很常见,但统计学上的显著水平只有在移植后一年或一年以上才能获得。此外,MICA抗体与移植排斥的紧密关系也见于没有HLA抗体的患者中。提示在没有HLA抗体的情况下,机体对MICA的免疫反应对移植排斥也起到很重要的作用。认识这一点很重要,因为传统上认为低移植排斥风险的患者,如首次移植,HLA配型较理想及没有HLA抗体的患者,当存在MICA抗体时,其移植后排斥的机率明显增高。由此我们推测,过去所谓低排斥风险的患者,当出现排斥反应时,可能由于当时未能检测的MICA抗体所致。
我们的研究无疑存在很大的局限性,例如:因为无法获得供者的DNA标本, 从而无法检测供者的MICA抗原分型,也无法获得供者抗体的特异性。此外,移植前患者体内如何产生了MICA抗体,其机理也不清楚。
因为HLA抗原(主要组织相容抗原)对移植排斥有较强的影响,次要组织相容抗原对肾移植的影响很少受到关注。在HLA完全相同的兄弟姊妹为供者的肾移植中,其排斥可能与次要组织相容位点较低的免疫遗传性有关。我们最近的一篇报道曾证实HLA完全相同的兄弟姐妹间的移植,其失败主要见于高PRA(HLA抗体)水平者。同时提示除HLA抗体外,其它免疫反应也可能参与了排斥反应。 与HLA相同,MICA位点也位于MHC中。因此,HLA完全相同的兄弟姐妹为供者的移植,MICA分型结果也应该是一致的。因此,兄弟姐妹为供者的HLA完全相同的肾移植,其存活率的不同应该与MICA抗原无关。然而,非血源关系的供者肾移植,HLA配型较好并不能代表MICA配型也好。我们的研究表明, HLA配型较好或低排斥风险的患者组,其移植后的排斥与MICA抗体明显相关。
HLA系统以外的其它基因的多态性也会影响肾移植存活率。例如:在许多肾移植排斥的患者血清中发现抗内皮细胞的抗体。与肾移植排斥可能相关的其它基因的多态性还包括:波形蛋白(Vimentin)、血小板特异性抗原、各种细胞因子的基因、化学激活因子及其受体,高血压蛋白酶-血管紧张素系统的某些成分等。
我们的早期研究显示MICA抗体是在移植后生成的,几项随后的研究也有类似的发现,我们推测,在移植排斥过程中,MICA抗原可能成为免疫攻击的靶子,因MICA和MICB均在排斥过程中被检测出来。由于MICA和MICB抗原在内皮细胞上表达,所以,当血清中存在补体时,MICA抗体可通过与MICA抗原的免疫反应而杀伤靶细胞。T细胞可以识别MICA抗原并被激活,其它的研究也显示MICA抗体在移植后产生的频率明显增高并与排斥相关。此外,在一项与Grosse-Wilde及其同事的合作研究中,我们进一步证实了MICA抗原对肾移植排斥的直接作用. 在这项研究中,我们分析了59名移植排斥患者的肾脏洗脱液,11份标本中检测出MICA抗体,其中5份标本只检测出MICA抗体,而没有HLA抗体。
我们最近的研究显示肾移植前具有MICA抗体者,其移植后的排斥机率明显增高,MICA抗体可以很容易地从血清中检测出来,对等待肾移植的患者进行MICA抗体的检测无疑有助于预测移植后的排斥风险。
尽管我们认为MICA抗体可导致肾移植排斥,但我们没有进一步证实这些MICA抗体是否为针对供者MICA抗原的特异性抗体。如果能证实患者血清中的MICA抗体为供者MICA抗原的特异性抗体,常规检测及降低甚至消除MICA抗体对肾移植至关重要。
参考文献:
1. Bahram S, Bresnahan M, Geraghty DE, Spies T, A second lineage of mammalian major histocompatibility complex class I genes. Proc Natl Acad Sci U S A 1994; 91: 6259-63.
2. Jinsushi M, Takehara T, Kanto T, et al. Critical role of MHC class I-related chain A and B expression on IEN-alpha-stimulated dendritic cells activeation: impairment in chronic hepatitis C virus infection. J Immunol 2003; 170: 1249-56.
3. Menier C, Riteau B, Carosella ED, Rouas-Freiss N. MICA triggering signal for NK cell tumor lysis is counteracted by HLA-G-mediated inhibitory signal, Int J Cancer 2002; 100: 63-70.
4. Tieng V, Le Bouguenec C, du Merle L, et al. Binding of Escherichia coli adhesin AfaE to CD55 triggers cell-suface expression of the MHC class I-related molecular MICA. Proc Natl Acad Sci U S A 2002; 99: 2977-82.
5. Zwirner NW, Marcos CY, Mirbaha F, Zou Y, Stasstny P, Identification of MICA as a new polymorphic alloantigen recognized by antibodies in sera of organ transplant recipients. Hum Immunol 2000; 61: 917-24.
6. Cardarelli F, Pascual M, Tolkoff-Rubin N, et al. Prevalence and significance of anti-HLA and donor-specific antibodies long-term after renal transplantation. Transpl Int 2005; 18: 532-40.
7. Kristersen T, Grunnet N, Madsen M, et. Al. Hyperacute rejection of kidney allograft may be caused by cytotoxic lymphocytes. Acta Pathol Microbiol Scand[C]1976; 84: 304-12.
8. Patel R, Terasaki PI. Significance of the positive crossmatch test in kidney transplantation. N Eng J Med 1969; 280: 735-9.
9. Jeannet M, Pinn VW, Flax MH, Winn HJ, Russell PS, Humoral antibodies in renal allotransplantation in man, N Eng J Med 1970; 282: 111-7.
10. Trpkov. K, Campbell P, Pazderka F, Cockfield S, Solez K, Halloran PF, Pathologic features of acute renal allograft rejection associated with donor-specific antibody: analysis using the Banff grading schema. Transplantation 1996; 61: 1586-92.
11. Lee PC, Terasaki PI, Takemoto SK, et al. All chronic rejection failures of kidney transplants were preceded by the development of HLA antibodies. Transplantation 2002; 74: 1192-4.
12. Zwirner NW, Dole K, Stastny P, Differential surface expression of MICA by endothelial cells, fibroblasts, keratinocytes, and monocytes. Hum Immunol 1999; 60: 323-30.
13. Zou Y, Mirbaha F, Lazaro A, Zhang Y, Lavingia B, Stastny P. MICA is a target for complement-dependent cytotoxicity with mouse monoclonal antibodies and human alloantibodies. Hum Immunol 2002; 63: 30-9.
14. Sumitran-Holgresson S, Wilczek HE, Holgresson J, Soderstrom K. Identification of the noclassical HLA molecules, MICA, as targets for humoral immunity associated with irreversible rejection of kidney allografts. Transplantation 2002; 74: 268-77.
15. Mizutani K, Terasaki PI, Bignon JD, et. al. Association of kidney transplant failure and antibodies against MICA. Hum. Immunol 2006; 67: 683-91.
16. Mizutani K, Terasaki PI, Rosen A, et al. Serial ten-year follow-up of HLA and MICA antibodiy production prior to kidney graft failure. Am J Transplant 2005; 5: 2265-72.
17. Mizutani K, Terasaki PI, Shih RN, Pei R, Ozawa M, Lee J. Fequency of MIC antibody in rejected renal transplant patients without HLA antibody. Hum Immunol 2006; 67: 223-9.
18. Zou Y, Heinemann FM, Grosse-Wilde H, et. al. Detection of anti-MICA antibodies in patients awaiting kidney transplantation, during the post-transplant course, and in eluates from rejected kidney allografts by Luminex flow cytometry. Hum Immunol 2006; 67: 230-7.
19. Kapan EL, Meier P. Nonpartametic estimation from incomplete observations. J Am Stat Assoc 1958; 53: 457-81.
20. Cox DR. Regression models and life-tables. JR Stat Soc [B]1972; 34: 187-220.
21. Hankey KG, Drachenberg CB, Papadimitrious JC, et al. MIC expression in renal and pancreatic allografts. Transplantation 2002; 73: 304-6.
22. Quiroga I, Salio M, Koo DD, et al. Expression of MHC class I-related chain B (MICB) molecules on renal transplant biopsies. Transplantation 2006; 81: 1196-203.
23. Opelz G, Non-HLA transplantation immunity revealed by lymphocytotoxic antibodies. Lancet 2005; 365: 1570-6.
24. Moraes JR, Stastny P, Allo-antibodies to endothelial cell antigens. In: Kissmeyer-Nielsen F, ed. VI international Hiscompatibility Workshop and Conference; 1975 June 29-July 5; ArhusDenmark. Copenhagen: Munksgaard, 1975; 391-7.
25. Idem. A new antigen system expressed in human endothelial cells. J Clin Invest 1977; 60: 449-54.
26. Vermehren D, Sumitran-Holgresson S. Isolation of precurse enothelial cells from peripheral blood for donor-specific crossmatching before organ transplantation. Transplantaton 2002; 74: 1479-86.
27. Carter V, Schenton BK, Jaques B, et al. Vimentin antibodies: a non-HLA antibody as a potential risk factor in renal transplantation. Transplant Proc 2005; 37: 654-7.
28. Kekomaki S, Kyllonen R, Salmela K, Koskimies S, Kekomaki R, Platelet-specific alloantigens in cadaveric renal transplantation: a prospective study: effect of HPA5b mismatch in acute vascular rejection of renal allografts. Tissue Antigens 2001; 57:154-7.
29. Tinckam K, Rush D, Hutchinson I, et al. The relative importance of cytokine gene polymorphisms in the development of early and late acute rejection and sixmonth renal allograft pathology. Transplantation 2005; 79: 836-41.
30. Abdi R, Tran TB, Sahagun-Ruiz A, et al. Chemokine receptor polymorphism and risk of acute rejection in human renal transplantation. J Am Soc Nephrol 2002; 13: 754-8.
31. Dragun D, Mulle DN, Brasen JH, et al. Angiotensin II type 1-receptor activating antibodies in renal-allograft rejection. N Eng J Med 2005; 352: 558-69.
32. Zhang Y, Stastny P, MICA antigens stimulate T cell proliferation and cellmediate cytotoxicity. Hum Immunol 2006; 67: 215-22.